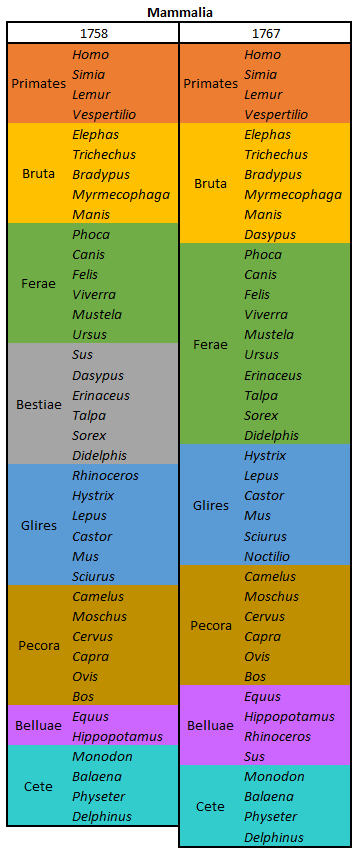
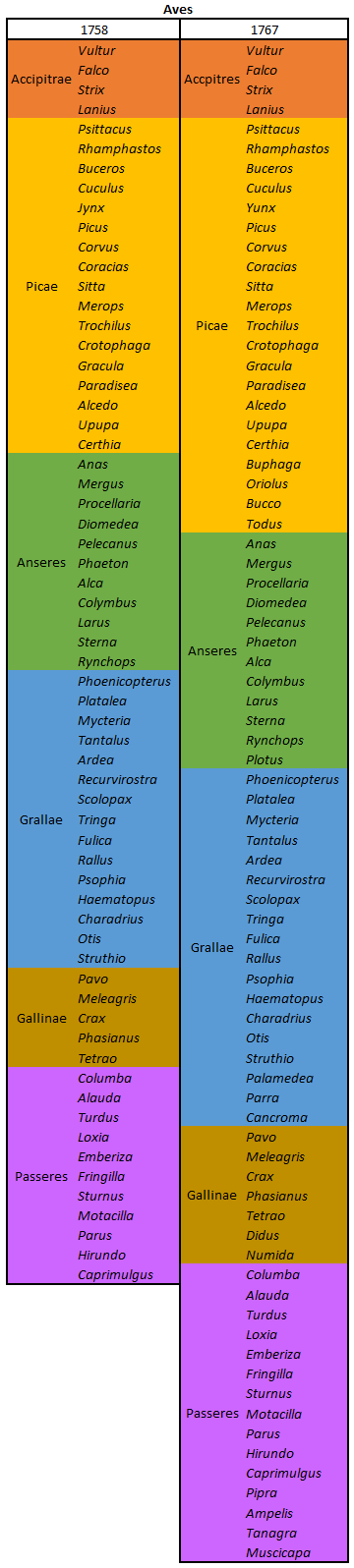
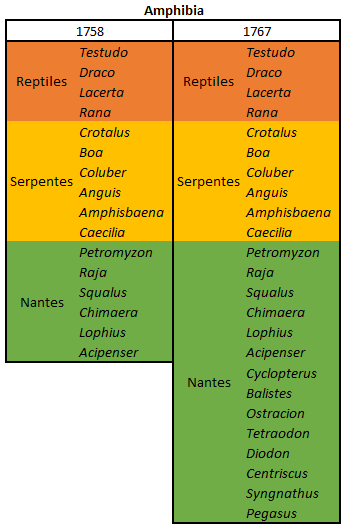
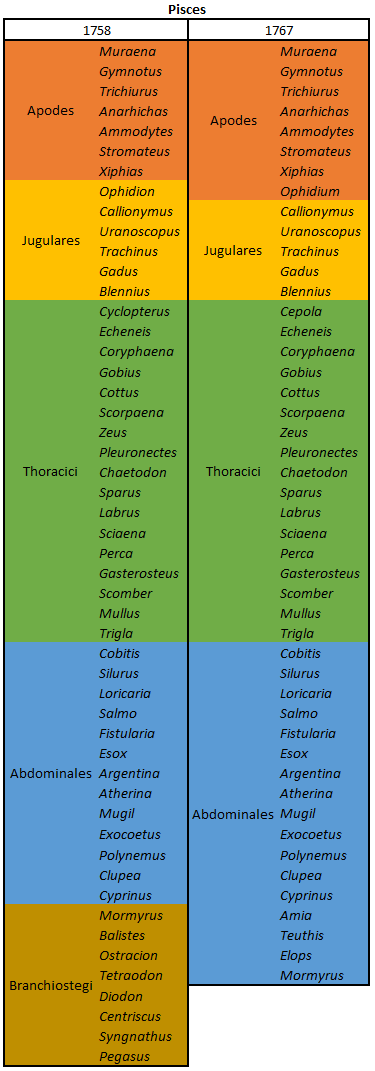
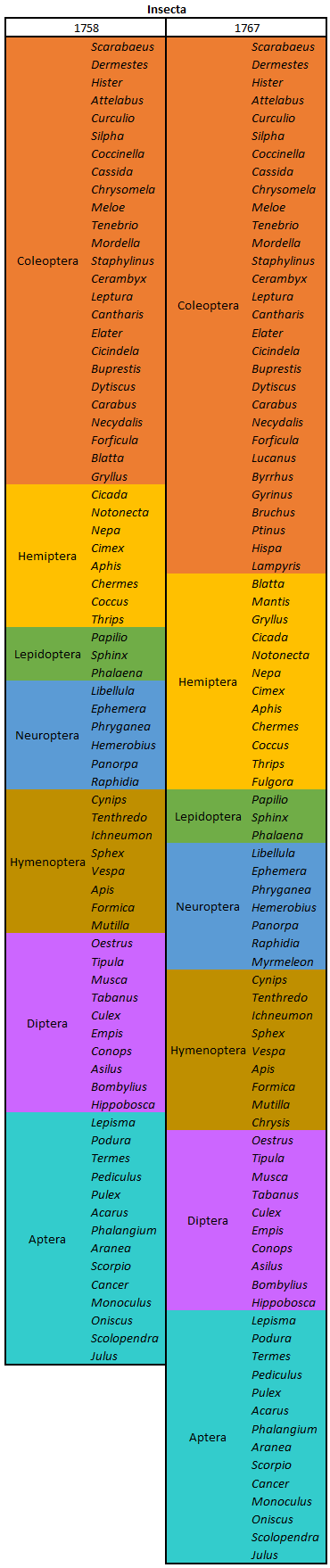
por Piter Kehoma Boll
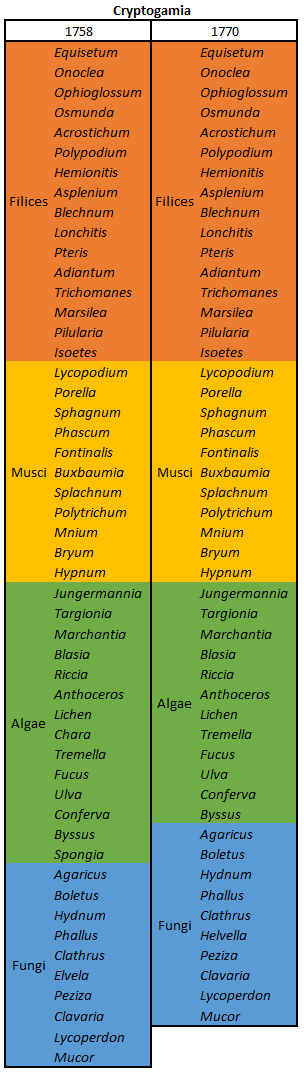
Esta é a última parte do sistema de classificação de plantas de Linnaeus lidando com plantas com flores (veja partes 1, 2, 3, 4, 5, 6 e 7) e apresenta três classes compostas por plantas que contêm mais de um tipo de flor. A última parte do sistema (parte 9) lidará com plantas sem flores.
21. Monoecia (“casa única”)
“Maridos habitam com mulheres na mesma casa, mas num quarto diferente”, isto é, órgãos masculinos e femininos ocorrem na mesma planta, mas em flores diferentes.
21.1 Monoecia Monandria (“casa única, marido único”), flores masculinas com um único estame: Zannichellia (capins-chifrudos), Ceratocarpus (frutos-chifres), Hippomane (mancenilheiras), Cynomorium (polegar-do-deserto).
21.2 Monoecia Diandria (“casa única, dois maridos”), flores masculinas com dois estames: Lemna (lentilhas-d’água).

O capim-chifrudo (Zanichellia palustris), esquerda), a mancinelheira (Hippomane mancinella), centro-esquerda) e o polegar-do-deserto (Cynomorium coccineum, centro-direita) eram classificados na ordem Monoecia Monandria, enquanto a lentilha-d’água-comum (Lemna minor, direita) era classificda na ordem Monoecia Diandria. Créditos a Yu Ito (capim-chifrudo), Hans Hillewaert (mancinelheira, polegar-do-deserto), e usuário do Wikimedia 3268zauber (lentilha-d’água).
21.3 Monoecia Triandria (“casa única, três machos”), flores masculinas com três estames: Typha (taboas), Sparganium (espadanas), Zea (milho), Tripsacum (guatemalas), Coix (lágrima-de-Jó), Olyra (carricilo), Carex (carriços), Axyris (ervas-de-porco), Omphalea (umbigueiros), Tragia (urtigas-de-nariz), Hernandia (hernândias), Phyllanthus (quebra-pedras, sarandis e outros).

A ordem Monoecia Triandria incluía (da esquerda para a direita, de cima para baixo) a taboa-comum (Typha latifólia), a espadana-delgada (Sparganium erectum), o milho (Zea mays), a guatemala-comum (Tripsacum dactyloides), a lágrima-de-Jó (Coix lacryma-jobi), o carricilo (Olyra latifolia), o carriço-cravo (Carex panicea), umbigueiro-da-Jamaica (Ophalea triandra), urtiga-de-nariz-da-Índia (Tragia involucrata), quebra-pedra-comum (Phyllanthus urinaria). Créditos a H. Zell (milho), Mason Brock (guatemala), Alex Popovkin (carricilo), Kristian Peters (carriço), e usuários do Wikimedia AnRo002 (taboa), Hugo.arg (espadana), Vinayaraj (lágrima-de-Jó, urtiga-de-nariz), Carstor (umbigueiro) e Atsuko-y (quebra-pedra).
21.4 Monoecia Tetrandria (“casa única, quatro machos”), flores masculinas com quatro estames: Betula (bétulas e amieiros), Buxus (buxo), Urtica (urtigas), Morus (amoreiras).

A bétula-anã (Betula nana, esquerda), o buxo-comum (Buxus sempervirens, centro-esquerda), a urtiga-comum (Urtica dioica) e a amoreira-negra (Morus nigra, direita) eram classificados na ordem Monoecia Tetrandria. Créditos a Uwe H. Friese (urtiga), Fritz Geller-Grimm (amoreira) e usuários do Wikimedia El Grafo (bétula) e Abrimaal (buxo).
21.5 Monoecia Pentandria (“casa única, cinco machos”), flores masculinas com cinco estames: Xanthium (carrapichos), Ambrosia (carpineiras), Parthenium (losnas-brancas), Iva (velhos-do-banhado), Amaranthus (carurus).

O carrapicho-grande (Xanthium strumarium), esquerda), a carpineira-comum (Ambrosia artemisiifolia, centro-esquerda), a losna-branca-americana (Parthenium integrifolium, centro), o velho-do-banhado-anual (Iva annua) e o caruru-espinho (Amaranthus spinosus) eram parte da ordem Monoecia Pentandria. Créditos a Javier Martin (carrapicho), Meneerke Bloem (carpineira), Krzysztof Ziarnek (losna-branca), e Forest & Kim Starr (caruru).
21.6 Monoecia Hexandria (“casa única, seis machos”), flores masculinas com seis estames: Zizania (arroz-bravo), Pharus (capim-de-talo), Solandra (uma espécie de identificação duvidosa).
21.7 Monoecia Heptandria (“casa única, sete machos”), flores masculinas com sete estames: Guettarda (gardênia-da-praia).

O arroz-bravo (Zizania aquatica, esquerda) e o capim-de-talo-largo (Pharus latifolius, centro) estavam alocados na ordem Monoecia Hexandria, enquanto a gardência-da-praia (Guettarda speciosa, direita) estava na ordem Monoecia Heptandria. Créditos a Michael Wolf (arroz-bravo), Alex Popovkin (capim-de-talo) e Cas Liber (gardênia-da-praia).
21.8 Monoecia Polyandria (“casa única, muitos machos”), flores masculinas com muitos estames: Ceratophyllum (rabos-de-raposa), Myriophyllum (pinheirinhas-d’água), Sagittaria (sagitárias), Theligonum (repolho-de-cão), Poterium (ervas-da-faca), Quercus (carvalhos), Juglans (nogueiras), Fagus (faias e castanheiras), Carpinus (carpinos), Corylus (avelaneiras), Platanus (plátanos), Liquidambar (liquidâmbares).

Linnaeus incluiu na ordem Monoecia Polyandria (da esquerda para a direita, de cima para baixo) o rabo-de-raposa-comum (Ceratophyllum demersum), pinheirinha-d’água-verticilada (Myriophyllum verticillatum), sagitária-comum (Sagittaria sagittifolia), carvalho-comum (Quercus robus), nogueira-comum (Juglans regia), faia-comum (Fagus sylvatica), carpino-comum (Carpinus betulus), avelaneira-comum (Corylus avellana), plátano-oriental (Platanus orientalis) e liquidâmbar-americano (Liquidambar styraciflua). Créditos a Christian Fischer (rabo-de-raposa, sagitária), Piotr Panek (pinheirinha-d’água), Krzysztof Ziarnek (carvalho), H. Zell (nogueira), Franz Xaver (carpino), André Karwath (avelã), Dimitar Nàydenov (plátano), Kurt Stueber (liquidâmbar) e usuário do Wikimedia Der Michels (faia).
21.9 Monoecia Monadelphia (“casa única, irmãos únicos”), flores masculinas com estamens fundidos em uma estrutura única pelos seus filamentos: Pinus (pinhos, lariços espruces e abetos), Thuja (tuias), Cupressus (ciprestes), Acalypha (acalifas), Croton (crótons), Jatropha (pinhões), Ricinus (mamonas), Sterculia (chichá), Plukenetia (amendoeira-inca), Hura (açacu).

A ordem Monoecia Monadelphia incluía (da esquerda para a direita, de cima para baixo) o pinho-da-Suíça (Pinus cembra), a tuia-ocidental (Thuja occidentalis), o cipreste-do-Mediterrâneo (Cupressus sempervirens), a acalifa-da-Índia (Acalypha indica), o cróton-de-jardim (Croton variegatus, agora Codiaeum variegatum), o pinhão-roxo (Jatropha gossypifolia), a mamona (Ricinus communis), o chichá-fedorento (Sterculia foetida), a amendoeira-inca (Plukenetia volubilis) e o açacu (Hura crepitans). Créditos a Wouter Hagens (tuia), J. M. Garg (acalifa, cróton, pinhão), Martina Nolte (mamona), Raju Kasambe (chichá), Hans Hillewart (açacu) e usuários do Wikimedia Moroder (pinho), Philmarin (cipreste) e NusHub (amendoeira-inca).
21.10 Monoecia Syngenesia (“casa única, mesma geração”), flores masculinas com estames unidos formando um cilindro: Trichosanthes (cabaças-de-cobra), Momordica (melão-de-São-Caetano e lufas), Cucurbita (morangas, abóboras, porongos, melacia), Cucumis (melões, pepinos), Bryonia (briônias), Sicyos (melão-estrela).
21.11 Monoecia Gynandria (“casa única, marido feminino”), flores masculinas com estames fundidos ao pistilo (estéril): Andrachne (andracne).

A ordem Monoecia Syngenesia inclui (da esquerda para a direita) a cabaça-de-cobra (Trichosanthes cucumerina), melão-de-São-Caetano (Momordica charantia), abóbora (Cucurbita pepo), pepino (Cucumis sativus), briônia-branca (Bryonia alba) e o melão-estrela-pequeno (Sicyos angulatus). Já a ordem Monoecia Gynandria incluía a andracne-comum (Andrachne telephioides, direita). Créditos a Florian Wickern (abóbora), H. Zell (pepino), Robert H. Mohlenbrock (melão-estrela), Vojtĕch Zavadil (andracne), usuário do flickr tanakawho (cabaça-de-cobra) e usuários do Wikimedia Prenn (melão-de-são-caetano) e Sannse (briônia).
22. Dioecia (“duas casas”)
“Maridos e mulheres vivem em quartos e casas diferentes”, isto é, órgãos masculinos e femininos ocorrem em flores diferentes e em plantas diferentes.
22.1 Dioecia Monandria (“duas casas, macho único”), flores masculinas com um único estame: Najas (náiades).
22.2 Dioecia Diandria (“duas casas, dois machos”), flores masculinas com dois estames: Vallisneria (valisnérias), Cecropia (embaúba), Salix (salgueiros).

A ordem Dioecia Monandria incluía uma única espécie, a náiade-espinhosa (Najas marina, esquerda). A ordem Dioecia Diandria incluía a valisnéria-comum (Vallisneria spiralis, centro-esquerda), a embaúba (Cecropia peltata, centro-direita) e o salgueiro-chorão (Salix babylonica, direita). Créditos a Stefan Lefnaer (náiade), Ori Fragman-Sapir (valisnéria), e usuários do Wikimedia Cmales (embaúba) e Viaouest (salgueiro).
22.3 Dioecia Triandria (“duas casas, três machos”), flores masculinas com três estames: Empetrum (camarinhas), Osyris (osire), Excoecaria (mangue-de-cego).

A camarinha-negra (Empetrum nigrum), esquerda), a osire (Osyris alba, centro), e o mangue-de-cego (Excoecaria agallocha, direita) eram parte da ordem Dioecia Triandria. Créditos a Krzysztof Ziarnek (camarinha), Hans Hillewaert (osire) e usuário Vengolis do Wikimedia (mangue-de-cego).
22.4 Dioecia Tetrandria (“duas casas, quatro machos”), flores masculinas com quatro estames: Trophis (trofe), Batis (manhã-do-mar), Viscum (viscos), Hippophae (cambroeiros-da-praia), Myrica (samoucos).

A manhã-do-mar (Batis maritima, esquerda), o visco-comum (Viscum album, centro-esquerda), o cambroeiro-da-praia-comum (Hippophae rhamnoides, centro-direita) e o samouco-de-brabante (Myrica gale, direita) compunham a ordem Dioecia Tetrandria. Créditos a Forest & Kim Starr (manhã-do-mar), Karunakar Rayker (cambroeiro-da-praia), Sten Porse (samouco) e usuário AnRo0002 do Wikimedia (visco).
22.5 Dioecia Pentandria (“duas casas, cinco machos”), flores masculinas com cinco estames: Pistacia (pistaches e lentiscos), Zanthoxylum (mamicas), Ceratonia (alfarrobeira), Iresine (iresine), Antidesma (hinembila), Spinacia (espinafre), Acnida (cânhamo-d’água), Cannabis (cânhamo), Humulus (lúpulo), Zanonia (zanônia), Fevillea (andiroba).

A ordem Dioecia Pentandria incluía (da esquerda para a direita, de cima para baixo) o pistache (Pistacia vera), a mamica-de-loba (Zanthoxylum clava-herculis), a alfarrobeira (Ceratonia siliqua), a iresine (Iresine celosia, agora Iresine diffusa), o espinafre (Spinacia oleracea), o cânhamo (Cannabis sativa), o lúpulo-comum (Humulus lupulus), a zanônia (Zanonia indica) e a andiroba-de-rama (Fevillea cordifolia). Créditos a Franz Xaver (iresine), Dinesh Valke (cânhamo), Fritz Geller-Grimm (lúpulo), P. Acevedo (andiroba), e usuários do Wikimedia NAEINSUN (pistache), Rickjpelleg (alfarrobeira), Rasbak (espinafre) e Vinayaraj (zanônia).
22.6 Dioecia Hexandria (“duas casas, seis machos”), flores masculinas com seis estames: Tamus (arrebenta-boi), Smilax (salsaparrilhas), Rajania (rajânias), Dioscorea (carás).

Linnaeus incluiu o arrebenta-boi (Tamus communis, agora Dioscorea communis, esquerda), a salsaparrilha-comum (Smilax aspera, centro) e o cará-do-ar (Dioscorea bulbifera) na ordem Dioecia Hexandria. Créditos a Alan Fryer (arrebenta-boi), Carsten Niehaus (salsaparrilha) e Dinesh Valke (cará).
22.7 Dioecia Octandria (“duas casas, oito machos”), flores masculinas com oito estames: Populus (choupos e álamos), Rhodiola (raiz-de-ouro).
22.8 Dioecia Enneandria (“duas casas, nove machos”), flores masculinas com nove estames: Mercurialis (mercuriais), Hydrocharis (nacos-de-rã).

A ordem Dioecia Octandria incluía o choupo-tremedor (Populus tremula, esquerda) e a raiz-de-ouro (Rhodiola rosea, centro-esquerda). Já a ordem Dioecia Enneandria incluía o mercurial-de-cão (Mercurialis perennis, centro-direita) e o naco-de-rã (Hydrocharis morsus-ranae, direita). Créditos a usuários do Wikimedia AnRo0002 (choupo), Amazonia Exotics U.K (raiz-de-ouro), BerndH (mercurial) e Salicyna (naco-de-rã).
22.9 Dioecia Decandria (“duas casas, dez machos”), flores masculinas com dez estames: Carica (mamoeiro), Kiggelaria (pêssego-bravo), Coriaria (coriárias), Datisca (datiscas).
22.10 Dioecia Polyandria (“duas casas, muitos machos”), flores masculinas com muitos estames: Cliffortia (clifórtia).

A ordem Dioecia Decandria incluía (da esquerda para a direita) o mamoeiro (Carica papaya), o pêssego-bravo (Kiggelaria africana), o sansá (Coriaria ruscifolia) e a datisca-asiática (Datisca cannabina). Já a clifórtia-pontuda (Cliffortia ruscifolia, direita) era um dos poucos membros da ordem Dioecia Polyandria. Créditos a Vijayan Rajapuram (mamoeiro), Franz Xaver (sansá), H. Zell (datisca) e usuários do Wikimedia JMK (pêssego-bravo) e Dwergenpaartje (clifórtia).
22.11 Dioecia Monadelphia (“duas casas, irmãos únicos”), flores masculinas com estamens fundidos em uma estrutura única pelos seus filamentos: Juniperus (juníperos ou sabinas), Taxus (teixos), Ephedra (efedras), Cissampelos (orelha-de-onça), Adelia (adélias).

Entre os membros da ordem Dioecia Monadelphia havia (da esquerda para a direita) a sabina-das-praias (Juniperus phoenicea), o teixo-europeu (Taxus baccata), a efedra-comum (Ephedra distachya) e a orelha-de-onça (Cissampelos pareira). Créditos a Isidre Blanc (sabina), Didier Descouens (teixo), Dinesh Valke (orelha-de-onça) e usuário do Wikimedia Le.Loup.Gris (efedra).
22.12 Dioecia Syngenesia (“duas casas, mesma geração”), flores masculinas com estames unidos formando um cilindro: Ruscus (gilbardeiras e louro-dos-poetas).
22.13 Dioecia Gynandria (“duas casas, marido feminino”), flores masculinas com estames fundidos ao pistilo (estéril): Clutia (relampagueiras).

A gilbardeira-comum (Ruscus aculeatus, esquerda) estava na ordem Dioecia Syngenesia, e a relampagueira (Clutia pulchella, direita) estava na ordem Dioecia Gynandria. Créditos a Fritz Geller-Grimm (gilbardeira) e usuário JMK do Wikimedia (relampagueira).
23. Polygamia (“muitos casamentos”)
“Maridos com esposas, assim como solteiros, vivem juntos em quartos diferentes”, isto é, há flores hermafroditas, assim como flores unicamente masculinas ou unicamente femininas na mesma espécie.
23.1 Polygamia Monoecia (“muitos casamentos, casa única”), flores hermafroditas ocorrem na mesma planta em que ocorrem flores unicamente masculinas ou unicamente femininas: Musa (bananeiras), Ophioxylon (pimenta-do-diabo), Celtis (lódãos), Veratrum (heléboros-falsos), Andropogon (gramões, jaraguazões, barbadouros, capins-limões, entre outros), Holcus (capins-moles, capins-elefantes, sorgos, entre outros), Apluda (grama-de-Maurício), Ischaemum (capins-moreias), Cenchrus (esporas-da-areia), Aegilops (trigos-de-perdiz), Valantia (valâncias), Parietaria (parietárias), Atriplex (oraches), Dalechampia (dalechâmpias), Clusia (clúsias), Acer (bordos), Begonia (begônias), Mimosa (mimosas, maricás, ingás, manjeriobas, angicos, entre outros).

A diversa ordem Polygamia Monoecia incluía (da esquerda para a direita, de cima para baixo) a bananeira (Musa paradisíaca, atualmente Musa × paradisíaca, um híbrido), a pimenta-do-diabo (Ophioxylon serpentinum, agora Rauvolfia serpentina), o lódão-bastardo (Celtis australis), o heléboro-branco (Veratrum álbum), o gramão-vassoura (Andropogon virginicus), o capim-mole-rasteiro (Holcus mollis), a grama-de-Maurício (<Apluda mutica), o capim-moreia-comum (Ischaemum aristatum), a espora-da-areia-comum (Cenchrus echinatus), o trigo-de-perdiz-barbado (Aegilops triuncialis), a valância-dos-muros (Valantia muralis), a parietária-ereta (Parietaria officinalis), a orache-de-jardim (Atriplex hortensis), a dalechâmpia-comum (Dalechampia scandens), a clúsia-menor (Clusia minor), o bordo-vermelho (Acer rubrum), a begônia-das-Antilhas (Begonia obliqua) e a sensitiva (Mimosa pudica). Créditos a Franz Xaver (bananeira), H. Zell (pimenta-do-diabo), Krish Dulal (lódão), Hedwig Storch (heléboro-branco), Harry Rose (gramão), Krzysztof Ziarnek (capim-mole), J. M. Garg (grama-de-maurício), Javier Martin (trigo-de-perdiz), Radio Tonreg (parietária), Stefan Lefnaer (orache), David J. Stang (clúsia), Yercaud Elango (begônia), usuário doflickr Macleay Grass Man (espora-da-areia), e usuários do Wikimedia Keisotyo (capim-moreia), Aroche (valância), Aniprina (dalechâmpia), Famartin (bordo) e Werner1122 (sensitiva).
23.2 Polygamia Dioecia (“muitos casamentos, duas casas”), flores hermafroditas e flores unicamente masculinas ou unicamente femininas ocorrem em plantas separadas: Gleditsia (espinheiros), Fraxinus (freixos), Diospyros (caquizeiros), Nyssa (tupelo), Anthospermum (antospermo), Arctopus (pé-de-urso), Pisonia (pisônias), Panax (ginseng).

Na ordem Polygamia Dioecia, Linnaeus incluiu (da esquerda para a direita, de cima para baixo) o espinheiro-da-Virgínia (Gleditsia triacanthos), o freixo-comum (Fraxinus excelsior), o caquizeiro-americano (Diospyros virginiana), o tupelo-d’água (Nyssa aquatica, o pé-de-urso (Arctopus echinatus), a pisônia-espinhenta (Pisonia aculeata) e o ginseng (Panax quinquefolius). Créditos a Andrew Butko (espinheiro), Donar Reiskoffer (freixo), Dinesh Valke (caquizeiro), Winfried Bruenken (pé-de-urso), Alex Popvkin (pisônia), Dan J. Pittillo (ginseng) e usuário do Flickr lucianvenutian (tupelo).
23.3 Polygamia Trioecia (“muitos casamentos, três casas”), há plantas apenas com flores masculinas, outras apenas com flores femininas e outras com flores tanto masculinas quanto femininas: Ficus (figueiras).

A ordem Polygamia Trioecia incluía apenas o gênero Ficus, com espécies como a figueira-comum (Ficus carica, esquerda) e a figueira-sagrada (Ficus religiosa, direita). Créditos ao usuário do Flickr INRA DIST (figueira-comum) e ao usuário do Wikimedia Amada44 (figueira-sagrada).
Ao classificar todas as plantas com flores de diferentes sexualidades em três classes, Linnaeus fez uma bagunça grande. Geralmente podemos ver ao menos um vago padrão em direção ao que foi posteriormente descoberto ser filogeneticamente verdadeiro em outros grupos, mas é difícil encontrar algo que ainda seja relevante hoje em dia aqui.
Nós só precisamos de mais uma parte e finalmente teremos concluído o sistema de Linnaeus!
– – –
Referência:
Linnaeus, C. (1758) Systema Naturae per regna tria Naturae…
– – –

Todas as imagens estão licenciadas sob uma Licença Creative Commons de Atribuição e Compartilhamento Igual 4.0 Internacional.