Rebello C. 2020.
El sobrepeso y la obesidad son los principales factores de riesgo de diabetes, enfermedades cardiovasculares y enfermedades pulmonares. Estas enfermedades son las afecciones de salud notificadas con mayor frecuencia que predisponen a las personas con infección por SARS-CoV-2 a requerir hospitalización, incluidas las admisiones en unidades de cuidados intensivos. La respuesta inmune innata es la primera línea de defensa del huésped contra una infección por coronavirus humano. Sin embargo, la mayoría de los coronavirus están armados con una estrategia u otra para superar la defensa antiviral del huésped, y la patogenicidad del virus está relacionada con su capacidad para suprimir la inmunidad del huésped. La naturaleza multifacética de la obesidad, incluidos sus efectos sobre la inmunidad, puede alterar fundamentalmente la patogenia del síndrome de dificultad respiratoria aguda y la neumonía, que son las principales causas de muerte por infección por SARS-CoV-2. Las concentraciones elevadas de leptina circulante son un sello distintivo de la obesidad, que se asocia con un estado de resistencia a la leptina. La leptina es secretada por los adipocitos en proporción a la grasa corporal y regula el apetito y el metabolismo mediante la señalización en el hipotálamo. Sin embargo, la leptina también envía señales a través de las vías Jak / STAT y Akt, entre otras, para modular el número y la función de las células T. Por tanto, la leptina conecta el metabolismo con la respuesta inmunitaria. Por tanto, parece oportuno que su desregulación tenga graves consecuencias durante una infección. Proponemos que la leptina puede ser el vínculo entre la obesidad y su alta prevalencia como comorbilidad de la infección por SARS-CoV-2.
En 2016, más de 1.900 millones de adultos tenían sobrepeso u obesidad . La obesidad reduce la esperanza de vida entre 9 y 13 años, y solo en los Estados Unidos (EE. UU.), Más de 300.000 muertes anuales están relacionadas con la obesidad.
El exceso de peso corporal aumenta el riesgo de enfermedad cardiovascular, diabetes tipo 2, hipertensión, dislipidemia, apnea obstructiva del sueño y algunos cánceres
Función de la leptina y las células inmunes
La leptina es un mediador importante de la inmunidad pulmonar y las concentraciones de leptina circulante elevadas crónicamente afectan las defensas pulmonares del huésped [ 34 , 45 ]. La leptina es producida por los adipocitos y regula la saciedad uniéndose a los receptores en el hipotálamo. La leptina también es secretada por células epiteliales bronquiales, neumocitos tipo II y macrófagos pulmonares [ 46 ]. A través de los receptores de los leucocitos, la leptina envía señales a través de muchas vías, incluida la vía Jak / STAT, para mediar en el número y la función de las células inmunitarias [ 47 , 48 , 49 , 50 ]. Durante una infección, la activación de las células T se acompaña de altos requisitos de energía para apoyar la biosíntesis de componentes intracelulares [47 ]. La leptina es liberada por los adipocitos en proporción a la masa grasa y es especialmente importante para que las células T activadas regulen al alza el metabolismo de la glucosa para satisfacer las demandas de la célula [ 51 ]. Si bien los primeros estudios muestran que la inanición y la deficiencia de leptina se asocian con una disminución de la reactividad inmunitaria [ 52 , 53 , 54 ], también se ha demostrado que la hiperleptinemia tiene efectos perjudiciales sobre la respuesta inmunitaria [ 55 , 56 ]. Estos estudios demuestran claramente que la leptina es un vínculo clave que conecta el estado nutricional y las respuestas inmunitarias.
Individuals with leptin deficiency have reduced T-cell numbers, decreased CD4 + helper T-cells (Th, contributor to cellular, humoral, and mucosal immunity), increased proliferation of regulatory T-cells (Treg, suppressor of effector T-cells activation and excessive inflammatory responses) and aberrant cytokine production [47,48,49,50]. In starvation, falling leptin levels act as a peripheral signal for conservation of energy as reserves start to deplete. Energy for vital functions such as central nervous system metabolism take precedence and systems that are not of immediate necessity such as reproduction or a finely tuned cognate immune response are inhibited. An adaptive neuroendocrine response featuring activation of the hypothalamic–pituitary–adrenal axis and suppression of the thyroid and gonadal axes accompanies the nutritional deprivation of starvation [52, 57]. Leptin blunts these adaptive changes [58]. Además, la leptina sesga la inducción de células Th hacia el subconjunto Th1, que tiene una respuesta más proinflamatoria que el subconjunto Th2 que tiene predominantemente funciones reguladoras [ 52 ].
Las interacciones entre el sistema inmunológico y los mecanismos neuroendocrinos integradores afectan la homeostasis del huésped. Los trastornos metabólicos que ocurren cuando el sistema inmunológico se activa durante procesos inflamatorios e infecciosos son bien conocidos [ 57 ]. La leptina regula la función neuroendocrina e inmunitaria, pero esta regulación se produce por debajo de un umbral crítico del nivel de leptina que recuerda a la privación crónica de nutrientes [ 53 ]. Por tanto, un déficit energético severo y una deficiencia de leptina aumentan la susceptibilidad a las enfermedades infecciosas. El sistema inmunológico puede soportar la inanición aguda, mientras que la inanición crónica altera la respuesta inmune y hace que los humanos y los ratones sean susceptibles a las infecciones [ 59 ].
También se ha demostrado que la leptina inhibe la apoptosis de las células del sistema inmunológico, y los déficits en los niveles de leptina circulante contribuyen a la respuesta inmunitaria defectuosa, en las deficiencias de energía y nutrientes. La administración de leptina inhibe la apoptosis tímica basal en ratas jóvenes en un 15 a 30%, actuando a través del sustrato del receptor de insulina 1 (IRS-1) y las vías de señalización de AKT. Curiosamente, el proceso de maduración de las ratas jóvenes va acompañado de una reducción de la expresión del receptor de leptina [ 54 ].
La leptina tiene un papel importante en la regulación metabólica de las células Treg. Estas células producen grandes cantidades tanto de leptina como de su receptor (LepR), que son el estímulo para un bucle inhibidor autocrino que limita la proliferación de las células Treg. Por tanto, los niveles elevados de leptina pueden promover la hiporreactividad de las células Treg [ 60 ]. De manera similar, la leptina producida por las células Treg contribuye a la activación de la vía diana de la rapamicina (mTOR) en mamíferos en las células Treg. La sobreexpresión de la vía leptina-mTOR en células Treg humanas recién aisladas conduce a hiporrespuesta y proliferación restringida [ 61]. Como la activación de mTOR apoya el crecimiento y la función de las células T, la regulación negativa parece contradictoria. Por tanto, debe existir una dosis y un momento en el que el estado metabólico intracelular controle la respuesta de las células Treg a través del eje leptina-mTOR [ 61 ].
La relevancia de la dosis apropiada de leptina también se manifiesta en la regulación del supresor de la señalización de citocinas 3 (SOCS3). La expresión de SOCS3, que es un regulador negativo clave de la señalización de citocinas, es inducida por la señalización de leptina a través de la vía Jak / STAT [ 62 ]. En las células Treg humanas, se encontró que SOCS3 se expresaba altamente en condiciones basales, y la estimulación aguda promovió su aumento consistente con el estado de hiporrespuesta de las células Treg. La neutralización de leptina rescató a las células Treg de su hiporrespuesta [ 60 ]. Por tanto, la leptina de alta circulación probablemente tendría un efecto perjudicial sobre la señalización intracelular y la respuesta a una infección.
En un modelo de ratón de obesidad inducida por la dieta, la hiperleptinemia se asoció con un aumento de la mortalidad, la diseminación viral y los niveles pulmonares de citocinas proinflamatorias, incluida la interleucina 6 (IL-6) y la IL-1β, después de la infección por el virus de la influenza (H1N1) pdm09. La administración de anticuerpos anti-leptina condujo a una disminución de la respuesta proinflamatoria y mejoró la patología pulmonar y la tasa de supervivencia [ 55 ]. En individuos con obesidad, la expresión de ARNm basal de SOCS3 en células mononucleares de sangre periférica aumenta en respuesta a la estimulación del ligando del receptor tipo Toll y se asocia con una respuesta disminuida de IFN-I en comparación con individuos sin obesidad [ 56 ]. El exceso de secreción de leptina de los adipocitos podría tener efectos paracrinos en las células T y promover el desarrollo de inflamación sistémica [47 ].
La obesidad surge de un desequilibrio energético crónico y uno de sus rasgos característicos es un estado de resistencia a la leptina marcado por una hiperleptinemia persistente. Los efectos de la leptina sobre las complicaciones metabólicas en la obesidad son numerosos [ 63 , 64 , 65 , 66 , 67 ]. De manera similar, los niveles elevados de leptina están presentes en la diabetes [ 68 , 69 ]. En pacientes con diabetes y SDRA, los niveles elevados de leptina en el líquido broncoalveolar se asocian con un aumento de la mortalidad [ 70 ].
Señalización del receptor de insulina
Tras la activación, las células T utilizan la glucólisis en presencia de oxígeno en lugar de una fosforilación oxidativa más eficiente desde el punto de vista energético para producir los precursores biosintéticos necesarios para el rápido crecimiento y proliferación celular. La activación de la vía de señalización fosfatidilinositol 3-quinasa (PI3K) / Akt / mTOR impulsa el metabolismo de la glucosa y la glucólisis aeróbica. Si el metabolismo de la glucosa es insuficiente, las células T adquieren un estado de hiporreactividad, que se conoce como anergia, o un estado de falta de respuesta, que se denomina agotamiento [ 47 ]. Aunque la activación de la vía PI3K / Akt / mTOR en las células T se produce principalmente mediante la activación del receptor de células T y la coestimulación de CD28 [ 71], también se ha demostrado que el receptor de insulina tiene un papel. La señalización aguas abajo del receptor de insulina, incluida la vía de señalización PI3K / Akt / mTOR, se reduce en las células T CD4 + de ratas transgénicas con caída del receptor de insulina [ 72 ]. La diabetes tipo 2 y la prediabetes son enfermedades resistentes a la insulina que comúnmente coexisten con la obesidad [ 10 ]. En estos sujetos, la señalización alterada del receptor de insulina puede contribuir a un suministro de energía insuficiente para que las células T efectoras monten una respuesta eficaz a la infección.
Inflamación del tejido adiposo
La inflamación del tejido adiposo es un sello distintivo de la obesidad y un evento crítico que conduce al desarrollo del síndrome metabólico, diabetes y enfermedad cardiovascular aterosclerótica [ 73 ]. El sistema inmunológico adaptativo tiene un papel clave en el inicio y mantenimiento de la inflamación del tejido adiposo. La acumulación de macrófagos en el tejido adiposo proporciona un mecanismo para la producción de adipocitos de citocinas proinflamatorias que se cree que están relacionadas con muchas de las consecuencias metabólicas de la obesidad [ 74 ]. Sin embargo, la infiltración de células T CD8 + precede a la acumulación de macrófagos y es esencial para la diferenciación, activación y migración de los macrófagos. El tejido adiposo contiene los estímulos necesarios para activar CD8 +Células T para producir una cascada inflamatoria local, sin necesidad de un aumento sistémico de células T. Un número reducido de células T CD4 + , que equilibran la respuesta inmunitaria, y de células Treg que se sabe que tienen efectos atenuantes sobre las respuestas inmunitarias adaptativas, pueden agravar los procesos inflamatorios del tejido adiposo en el desarrollo de la obesidad [ 75 ].
En los seres humanos con obesidad, los depósitos de tejido adiposo contienen ~ 40% de macrófagos, que son importantes para la función inmunitaria [ 74 ]. Son mediadores primarios de la respuesta inmune innata y tienen un papel importante en la respuesta inmune adaptativa. Por lo tanto, uno podría esperar que los individuos con obesidad tuvieran una mayor mortalidad cuando padecen SDRA, que es impulsado al menos en parte por un medio de citocinas proinflamatorias. Los informes de que la obesidad no se asocia con la mortalidad en pacientes ventilados mecánicamente con lesión pulmonar aguda han dado lugar a la paradoja de la obesidad en el SDRA [ 76 , 77 ].
Obesidad y mortalidad en SARS-CoV-2
La alta mortalidad entre los pacientes con obesidad que manifiestan SRAS-CoV-2 ha llevado a la idea de que el SRAS-CoV-2 ha refutado la paradoja de la obesidad en el SDRA [ 78 ]. Sin embargo, según la evidencia de pacientes con obesidad y neumonía, y modelos de roedores de hiperleptinemia con y sin obesidad, los niveles basales elevados de leptina provocan defectos inmunitarios. Las deficiencias en la respuesta de los neutrófilos y una respuesta antiviral insuficiente predisponen a un aumento de la susceptibilidad y la gravedad de las infecciones respiratorias [ 34 , 45 ]. En pacientes no obesos con diabetes y SDRA, los niveles elevados de leptina y la disminución de la señalización del receptor de leptina se asociaron con resultados clínicos deficientes [ 70]. Los niveles elevados de leptina plasmática circulante en la obesidad se asocian con reducciones en los niveles de biomarcadores clave de inflamación y una respuesta inflamatoria atenuada en el SDRA y la neumonía, que exacerba los resultados de las infecciones pulmonares [ 34 ]. Durante una infección, la activación de las células T se acompaña de altos requisitos de energía para apoyar la biosíntesis de los componentes intracelulares [ 47 ]. Desde una perspectiva evolutiva, la regulación a la baja de vías no esenciales y que consumen energía, como la activación de las células inmunitarias, es pragmática [ 47 ]. Dado que la leptina es un vínculo entre el metabolismo y la respuesta inmune, parece apropiado que su desregulación tenga graves consecuencias durante una infección.
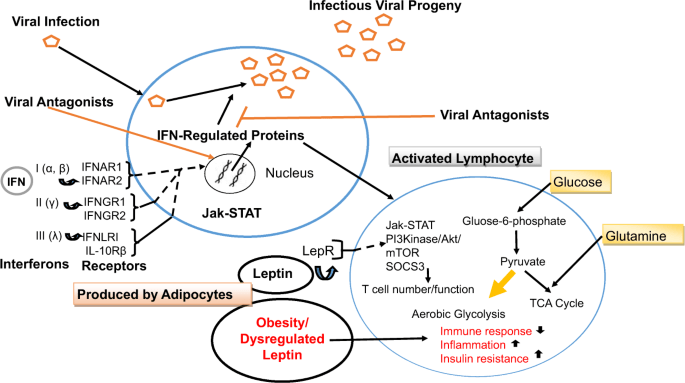
En las infecciones por SARS-CoV-2, la linfopenia parece ser un hallazgo constante y ocurre en aproximadamente el 80% de los pacientes. Los pacientes que han sucumbido a la infección presentan una marcada disminución de los niveles de linfocitos T CD4 + y CD8 + circulantes , y en el tejido pulmonar predominan las células mononucleares como los macrófagos [ 79 , 80 , 81 ]. La linfopenia y el predominio de macrófagos inmunes innatos también son una característica de la infección por SARS-CoV, y esta puede ser una estrategia adoptada por el CoV para suprimir la respuesta antiviral del huésped [ 82]. La insuficiencia inmunológica o la dirección errónea pueden aumentar la replicación viral o hacer que su aclaramiento sea ineficaz, lo que puede causar daño tisular, estimulación de una mayor activación de macrófagos y un bucle incontrolado de autoamplificación. El síndrome de tormenta de citocinas resultante puede precipitar una insuficiencia multiorgánica [ 83 ]. Al alterar el entorno metabólico, la obesidad y las condiciones concomitantes de hiperleptinemia y resistencia a la insulina interrumpen la función de las células T, lo que produce una respuesta de las células T suprimida a la infección [ 34 , 84 ]. En la figura 1 se presenta un resumen esquemático de la activación y respuesta del sistema inmunológico a una infección viral .

Las partículas de virión se ilustran mediante pentágonos abiertos. Los tres tipos distintos de IFN incluyen: IFN de tipo I (IFN-α e IFN-β), IFN de tipo II (IFN-γ) e IFN de tipo III (IFN-λ) .Todos los tipos de IFN se unen a receptores distintos pero activan receptores similares. vías de señalización y respuestas transcripcionales. Los receptores de IFN de tipo I, tipo II y tipo III son heterodímeros compuestos por subunidades IFNAR1 e IFNAR2, subunidades IFNGR1 e IFNGR2 y subunidades IFNLR1 e IL10Rβ, respectivamente. Los productos codificados por virus antagonizan las vías de señalización de IFN y la actividad bioquímica de las proteínas celulares inducidas por IFN para frustrar la defensa antiviral del huésped. En los linfocitos activados, la oxidación de lípidos se regula a la baja y la glucólisis aumenta en presencia de oxígeno. junto con la oxidación de la glutamina para producir los precursores biosintéticos necesarios para el rápido crecimiento y proliferación celular. La leptina envía señales a través de las vías Jak / STAT y Akt, entre otras, para mediar el número y la función de las células inmunitarias. La desregulación de la leptina en la obesidad tiene efectos perjudiciales durante una infección. LepR: receptor de leptina.
Otra característica del SDRA asociado con el SARS-CoV-2 es que se presenta en una forma atípica de mecánica pulmonar conservada e hipoxemia grave [ 85 ]. En pacientes con obesidad, la acumulación de grasa en el mediastino y en las cavidades abdominal y torácica disminuye la capacidad residual funcional al alterar las propiedades mecánicas de la pared torácica. El diafragma está elevado y su presión hacia abajo es limitada, lo que hace que aumente la presión pleural [ 21 ]. En pacientes en decúbito supino con obesidad abdominal, la excursión diafragmática disminuye dificultando la ventilación [ 86 ]. Se recomienda el decúbito prono para mejorar la oxigenación en pacientes con hipoxemia refractaria debido al SDRA por SARS-CoV-2 [ 87], pero los desafíos físicos y los riesgos involucrados pueden exacerbarse en la obesidad.
Conclusiones
La interacción entre el SARS-CoV-2 y la defensa antiviral del huésped determina el curso y la patogénesis de la infección viral. La obesidad y la leptina circulante elevada predisponen a los pacientes a la morbilidad y la mortalidad de la infección por SARS-CoV-2 a través de una respuesta inmunitaria comprometida. Esta respuesta inmune disminuida que no logra contener la replicación viral junto con altos niveles de quimiocinas puede explicar por qué el SARS-CoV-2 ha pasado factura a las personas con obesidad. Además, la obesidad dificulta la ventilación mecánica y los efectos mecánicos de la compresión pulmonar en la obesidad contribuyen a los síntomas respiratorios [ 88 ].
La respuesta antiviral del huésped se encuentra en el meollo del control de la infección por SARS-CoV-2 tanto a nivel celular como del organismo. Una respuesta inmune debilitada puede desencadenar una serie de eventos que culminen en inmunopatogénesis y una mayor liberación de citocinas que pueden resultar fatales. Las altas tasas de mortalidad por infección por SARS-CoV-2 en individuos con obesidad sugieren que las consecuencias metabólicas de la obesidad comprometen las defensas antivirales del huésped. La leptina circulante elevada es una característica común de la obesidad y el factor mediador que vincula el metabolismo con la inmunidad. Por lo tanto, el papel de la leptina en la patogenia del SARS-CoV-2 merece ser investigado junto con los efectos inmunomoduladores innatos de las proteínas virales codificadas por el SARS-CoV-2 en pacientes con obesidad.
La alta patogenicidad del virus en la obesidad podría ser el resultado de contramedidas de virus únicas para suprimir la producción de interferón del huésped que interactúa con el medio metabólico de la obesidad. Si un inhibidor de NLRP3 de molécula pequeña podría constituir un enfoque para tratar el SARS-CoV-2, particularmente en el estado de inflamación crónica, como existe en la obesidad, merece una mayor investigación. También merece investigación cómo el estado proinflamatorio del tejido adiposo en la obesidad podría contribuir a una activación prolongada de bajo grado de las células T y su senescencia prematura marcada por anergia y agotamiento. Es importante destacar que en el desarrollo de vacunas, el estado inmunodeprimido predicado por la obesidad puede necesitar ser considerado de la misma manera que la edad avanzada.